Une étude de suivi bien conçue peut fournir des informations approfondies sur n'importe quel domaine thérapeutique. En utilisant les résultats d'une étude de suivi d'APLUSA sur le marché du myélome multiple, cette série d'articles de blog examine les informations clés qu'une telle étude de suivi peut fournir.
Contexte du marché du MM
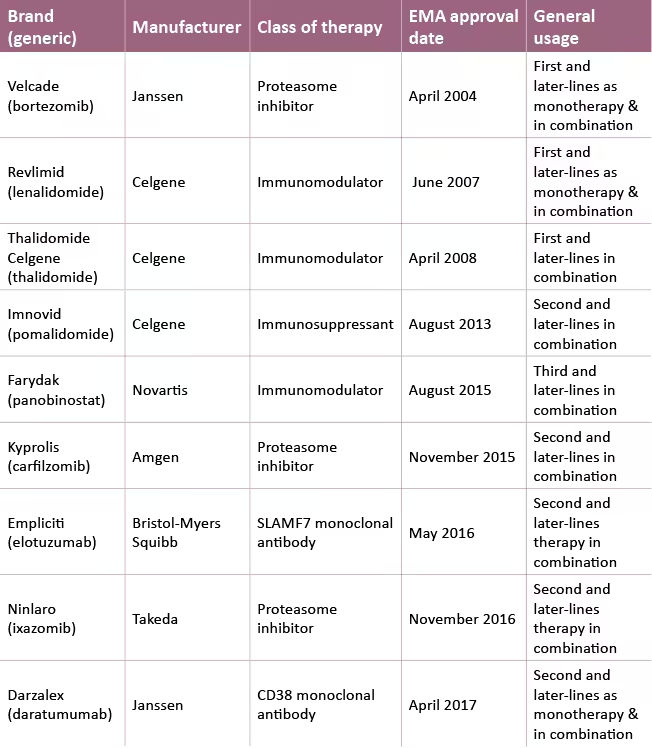
L'Agence européenne des médicaments (EMA) a approuvé plusieurs thérapies de marque pour le traitement du myélome multiple (MM) dans les pays de l'Union européenne, y compris les cinq premiers pays de l'UE.
Ces thérapies, dans l'ordre de leur date d'approbation, sont les suivantes
Les études de suivi sont menées afin de répondre à des questions prédéfinies liées à la marque que les spécialistes du marketing des soins de santé se posent à propos de leurs produits. Ces questions peuvent, par exemple, porter sur les points suivants
- les indications dans lesquelles une marque est en concurrence avec le temps supplémentaire
- l'évolution de la pénétration de la marque dans les différentes lignes de traitement
- s'il existe des différences dans la manière dont la marque est prescrite et perçue dans les cinq principaux pays de l'UE
Informations clés sur le Velcade® et le Revlimid® dans le marché de la polyarthrite rhumatoïde
Velcade® (bortezomib) de Janssen
Velcade®, un inhibiteur du protéasome, est approuvé en association avec le melphalan et la prednisone pour les adultes non traités antérieurement qui ne peuvent pas recevoir une chimiothérapie à haute dose avec une greffe de cellules souches (GCS), en association avec la dexaméthasone plus ou moins la thalidomide pour les patients adultes traités antérieurement qui recevront une GCS. Il est également approuvé seul ou en association avec la doxorubicine ou la dexaméthasone en deuxième ou dernière ligne.
Comme le révèle le tracker sur le myélome multiple d'APLUSA, Velcade® détient la part prédominante du traitement d'induction de première ligne et la part principale du traitement de première ligne sans TCS dans les cinq principaux pays de l'UE. Ses parts dans le traitement d'entretien de première ligne et dans le traitement de deuxième ligne sont modérées, tandis que la pénétration dans le traitement de troisième ligne et dans le traitement de dernière ligne est relativement faible. Au cours des derniers trimestres, la pénétration de Velcade® parmi les 5 premiers pays de l'UE pour les traitements d'entretien a diminué d'environ 10 points. Les autres tendances de pénétration de Velcade® au cours de cette période sont restées stables. Au cours des derniers trimestres au Royaume-Uni, un changement notable dans la part des patients du VCd5 au Vd6 n'a pas eu d'impact sur la pénétration globale de Velcade® ou d'autres produits de marque.
Revlimid® (lénalidomide) de Celgene
Le Revlimid®, un agent immunomodulateur, est approuvé en monothérapie pour le traitement d'entretien des patients nouvellement diagnostiqués après une GCS, en association avec la dexaméthasone plus ou moins Velcade® ou avec le melphalan et la prednisone chez les patients nouvellement diagnostiqués non éligibles pour une GCS, et en association avec la dexaméthasone dans la deuxième ligne et les lignes ultérieures.
Le tracker d'APLUSA montre que Revlimid® est en tête de la pénétration des patients dans le traitement d'entretien de première ligne, ainsi que dans les traitements de deuxième et troisième ligne. Dans les autres indications du MM, la pénétration de Revlimid® est modérée.
Au cours des derniers trimestres, la pénétration du Revlimid® dans le top 5 des patients de première ligne non-SCT et d'entretien de l'UE a connu une croissance notable. La pénétration des autres produits est restée stable dans l'ensemble. La croissance du nombre de patients de première ligne non-SCT s'explique en grande partie par le passage du VMP7 au RVd8 en Italie et en Espagne. En raison des changements entre les combinaisons Revlimid®/ Velcade®, la pénétration globale de Velcade® auprès des patients est récemment restée stable.




